
作者:GCP办
来源:GCP办
发布时间:2025/9/23 9:41:26
医院机构办公室组成情况及联系方式
机构主任:孙云 | 机构办公室主任:周夏慧 |
| 机构办公室秘书:林子潇 | 机构药库管理员:何晓乐 |
| 机构质量管理员:周夏慧、黄志有、潘蓉蓉 | 机构档案管理员:潘丽珍 |
办公地址:温州市鹿城区六虹桥蛟尾路9号温州市中医院综合楼E208
办公室电话:0577-56671549
邮箱:wzszyygcp@163.com
联系人:周夏慧、林子潇
受理时间:工作日
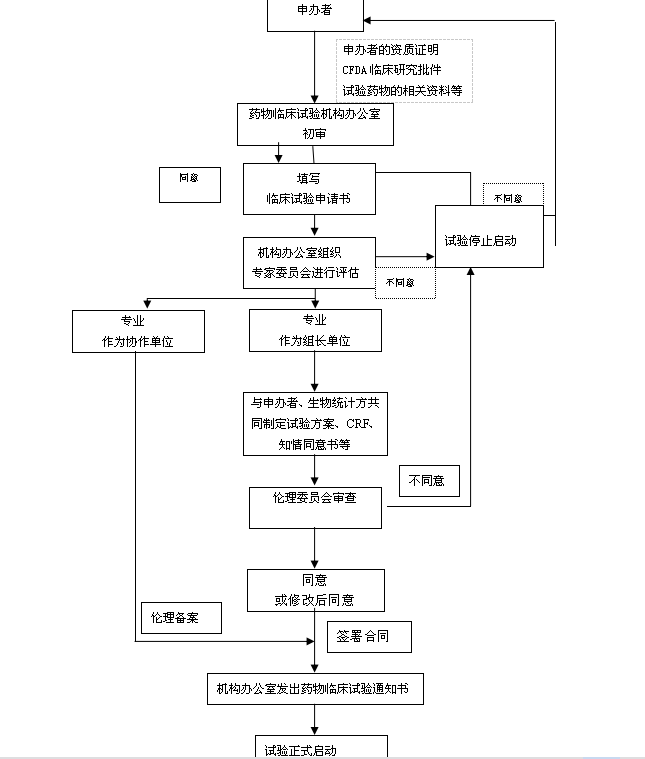
药物临床试验运行管理示意图
临床试验开始前
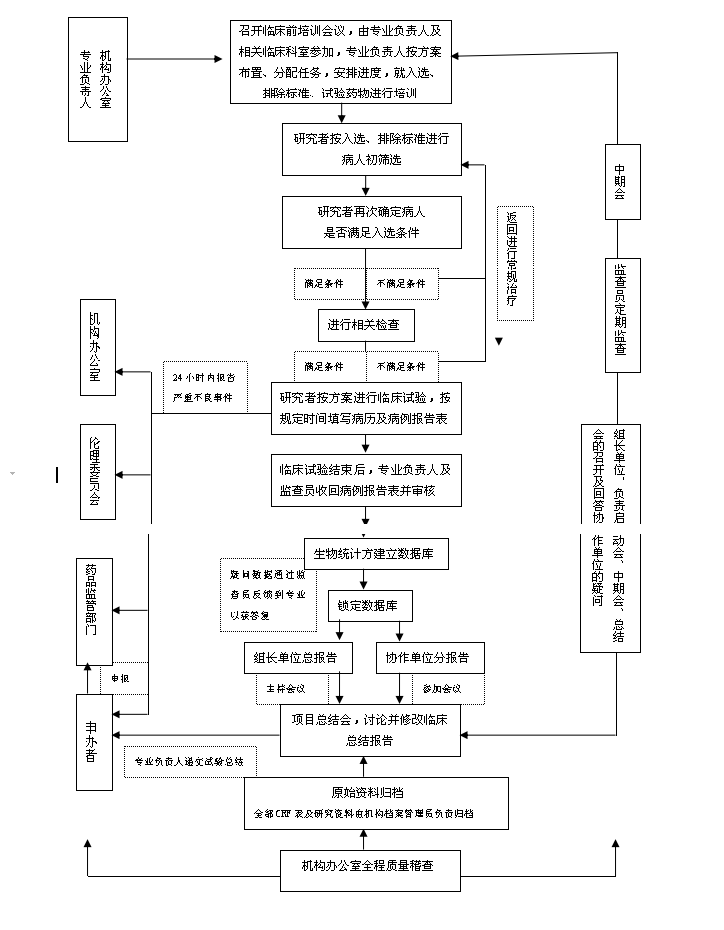
试验进行期间及试验结束
药物临床试验运行管理程序
l 机构办公室接待申办者;
l 机构负责人根据申办者提供的文件,确定本机构是否承接该项目,必要时提交专家委员会讨论;
l 确定可承担该项目之后,机构负责人任命主要研究者;
l 主要研究者和申办者制定研究方案、知情同意书、CRF或多中心讨论修改;
l 伦理委员会审议、批准;
l 主要研究者根据承担的项目,组织制订、修改、补充SOP;
l 机构与申办者签署临床研究协议书或合同书;
l 机构向专业组及辅诊科室发送书面通知;
l GCP药房接受和管理试验用药物;
l 研究人员以及试验相关人员接受试验前培训;
l 临床试验启动、具体实施;
l 监查员对CRF及病历等原始数据的一致性监查;
l 临床试验的质量和安全性监查;
l 主要研究者、统计学专家、监查员召开中期会议,审查研究方案执行情况、进度和存在问题;
l 完成的CRF需要经过主要研究者审核后提交机构办公室质控后方可由申办方收回;
l 主要研究者、统计学专家分析总结;
l 研究者撰写总结报告;
l 总结报告由主要研究者签字、机构负责人审核、批准;
l 退还剩余试验药物,监查员签收;
l 文件资料归档,档案管理员签收存档;
l 向申办者发出临床试验总结报告;
临床试验结束。
热点新闻
版权所有:温州市中医院 Copyright (C) 2005-2012 www.wzszyy.com All rights reserved 浙WWS标2011022800010号 浙ICP备15041147号-1 浙ICP备15041147号-2
技术支持:联科科技





